Los ensayos clínicos de la vacuna china de Sinopharm contra el COVID-19 se han reanudado, anunció hoy la ministra de Salud, Pilar Mazzeti. Los síntomas del síndrome de Guillain-Barré en un voluntario que recibió la vacuna llevaron a que el Instituto Nacional de Salud suspendiera las pruebas, el 11 de diciembre y creara una comisión de expertos para investigar el caso. Esta ha sido la primera reacción adversa seria de un participante en dicho estudio, que incluye a 12 mil voluntarios, 11,700 de los cuales ya han recibido las dosis de prueba.
Actualización 16 de diciembre de 2020
El Instituto Nacional de Salud (INS) autorizó hoy la reanudación de los ensayos clínicos con voluntarios en el Perú de la vacuna contra el COVID-19 del laboratorio chino Sinopharm. Así lo anunció la ministra de Salud, Pilar Mazzeti, durante una conferencia del presidente Francisco Sagasti y su gabinete ministerial por el primer mes de su gobierno.
La titular de Salud adelantó que el Gobierno peruano se encuentra en negociaciones con Sinopharm para la compra de vacunas y que este 20 de diciembre tendrán una reunión con los representantes del gigante farmacéutico chino.
Aproximadamente 8 mil voluntarios ya han recibido las dos dosis de la vacuna del gigante farmacéutico chino Sinopharm en los ensayos que realiza la Universidad Peruana Cayetano Heredia en nuestro país. Tres mil 700 participantes en el estudio solo han recibido una dosis, mientras que 300 voluntarios aún no han recibido ninguna, según información brindada a Convoca.pe por el investigador a cargo del estudio, Germán Málaga.
Nota original 12 de diciembre de 2020
Cuando solo faltaba aplicar la vacuna contra el Covid-19 de la farmacéutica china Sinopharm a 300 de los 12 mil voluntarios programados en el Perú, el Instituto Nacional de Salud (INS) suspendió los ensayos clínicos que patrocina la Universidad Peruana Cayetano Heredia porque uno de los participantes que ya había recibido la vacuna presentó problemas neurológicos.
El doctor Germán Málaga, responsable de los ensayos clínicos en nuestro país, dijo a Convoca.pe que, durante el monitoreo que realizan a los voluntarios que recibieron las dosis, se reportó que uno de ellos presentó una disminución de fuerza en el movimiento de sus piernas, lo que les hace sospechar que tendría el síndrome de Guillain-Barré.
Tras informar al INS, dicha entidad decidió suspender temporalmente los ensayos clínicos en nuestro país. Por tanto, no se aplicará la vacuna a los nuevos voluntarios, que son 300, ni a los 8 mil que ya habían recibido la primera dosis y que deben recibir la segunda.
La vacuna de China National Pharmaceutical Group Co. Ltd. (Sinopharm) es aplicada en el Perú por la Universidad Peruana Cayetano Heredia, que figura como patrocinadora del estudio financiado China National Biotec Group Company Limited. El 24 de agosto último inició los ensayos clínicos con voluntarios peruanos mayores de 18 años en las sedes de esta universidad y de la Universidad Nacional Mayor de San Marcos.
Para investigar lo ocurrido con el voluntario, eI INS dispuso que se conforme una comisión ad hoc de neurólogos. Aunque no hay un plazo para que realicen las indagaciones, Málaga dijo que espera que esta suspensión sea de 48 a 72 horas, con el fin de que puedan retomar las investigaciones.
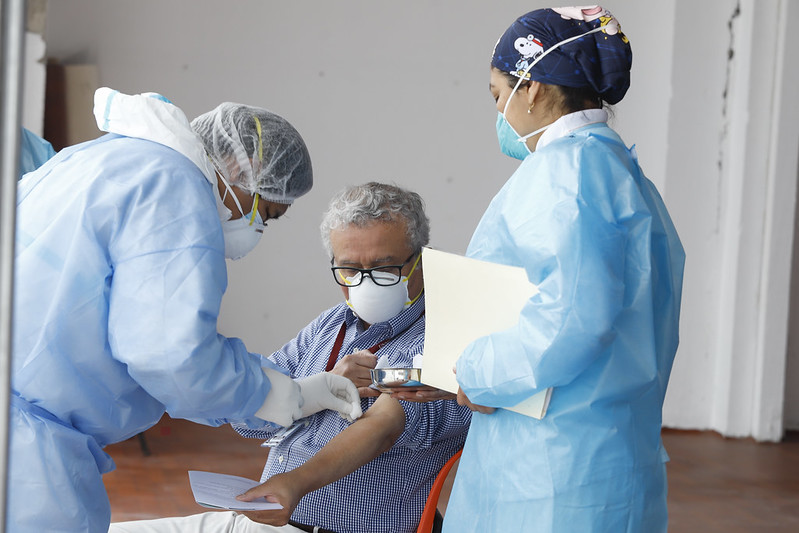
Más de 11 mil voluntarios han recibido la vacuna china de Sinopharm. Foto: Difusión
El Ministerio de Salud respaldó la decisión del INS de suspender temporalmente los ensayos clínicos de la vacuna de Sinopharm y destacó que es una medida de seguridad contemplada en el Reglamento de Ensayos Clínicos y protocolos establecidos para proteger la salud de los sujetos de investigación.
"El evento adverso presentado se encuentra en investigación para determinar si está relacionado con la vacuna o existe otra explicación", señaló en un comunicado difundido este 12 de diciembre.
Aunque no hay un plazo para que se realice la investigación del caso, esperamos que la suspensión temporal solo sea de 48 a 72 horas para retomar los estudios", Germán Málaga, responsable de los ensayos clínicos de Sinopharm en el Perú
Málaga informó que, de acuerdo con el Reglamento de Ensayos Clínicos, deben reportar lo que ocurra con los voluntarios. Por ejemplo, han reportado hospitalizaciones por diversas enfermedades, como apendicitis, aunque no estén relacionadas con la aplicación de la vacuna.
Entre los efectos adversos más comunes en las personas tras la aplicación de la vacuna de Sinopharm, Málaga destacó el dolor en la zona de aplicación de la vacuna y dolor de cabeza.
Málaga reveló a Convoca.pe que se han reportado 10 casos de COVID-19 entre las 11, 700 personas que han participado en los ensayos clínicos. Debido a que es un estudio de tipo "doble ciego", no se sabe si los contagiados recibieron la vacuna o un placebo (Sustancia inocua).
En China, ya se está aplicando la vacuna de Sinopharm a diversos sectores de la población. Foto: Difusión
La vacuna de Sinopharm ya tiene autorización de las autoridades regulatorias en China y en los Emiratos Árabes, donde ya se viene aplicando. Se está tramitando el permiso en otros países.

 Menú
Menú
 Buscar
Buscar

 Sé el primero en leer nuestras publicaciones
Sé el primero en leer nuestras publicaciones