

Afirmación de Bustamante sobre falta de aprobación de Sinopharm en países de "alta vigilancia farmacológica" es falsa
By Fiorella Montaño | 5 August, 2021
El biólogo Ernesto Bustamante, representante de Fuerza Popular en el Congreso, dio una declaración falsa sobre la autorización de la vacuna de Sinopharm.
Ernesto Bustamante, congresista de Fuerza Popular, remitió una carta al titular de la Presidencia del Consejo de Ministros (PCM), Guido Bellido, en la que expresó que la vacuna del laboratorio chino Sinopharm "no ha sido aprobada por ninguna autoridad sanitaria del mundo que sea de alta vigilancia farmacológica". Tras revisar las normas nacionales e internacionales y conversar con especialistas, Convoca Verifica, la unidad de fact-checking de Convoca.pe, concluye que lo afirmado por el legislador sobre la vacuna asiática que se distribuye en el país es falso.
En primer lugar, hay que aclarar que el término correcto al que hace referencia Ernesto Bustamante no es 'alta vigilancia farmacológica' sino 'alta vigilancia sanitaria'. Así lo explica a Convoca Verifica la directora de la Dirección General de Medicamentos, Insumos y Drogas (Digemid), Carmen Ponce. Esta entidad es la encargada de evaluar y autorizar la distribución de las vacunas en todo el país.
Ponce señala que el término de 'país de alta vigilancia sanitaria' hace referencia a estados que poseen autoridades reguladoras de salud con experiencia, que manejan un alto nivel de transparencia y tienen indicadores elevados de salud.
La propia legislación nacional reconoce a estos países. El Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios, aprobado en el 2011, señala que "el país de alta vigilancia sanitaria es aquel que mantiene indicadores de salud pública elevados, muestra cobertura universal en seguro de salud a su población o la prestación de servicios de protección social están asegurados".
Asimismo, el que "posee bajas tasas de mortalidad materno infantil, presenta desarrollo de la infraestructura de saneamiento básico, ejerce higiene laboral y protección del medio ambiente, posee regulaciones y sistemas de vigilancia y control en salud fortalecidos, así como un sistema de garantía de la calidad consolidado, entre otros indicadores que lo colocan como país referente en el mundo en vigilancia de la salud".

Es falsa la información consignada en la carta de Ernesto Bustamante.
Un ejemplo de un país considerado de alta vigilancia sanitaria es Estados Unidos, cuya autoridad reguladora, encargada de autorizar la administración de vacunas y medicamentos en el país, es la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés).

Decreto Supremo 001-2019-SA que establece cuáles son los países considerados de alta vigilancia sanitaria en Perú.
Carmen Ponce explica que esta denominación solo es una referencia que sirve para agilizar la autorización de medicamentos en el país. En el caso de Perú, la Digemid como autoridad reguladora es la encargada de autorizar la distribución de medicamentos, previa evaluación. Cuando un medicamento o vacuna es aprobado previamente en un país de alta vigilancia sanitaria, permite a Digemid convalidar requisitos para entregar una autorización de forma más expeditiva.
La funcionaria de la Digemid indica que de esta forma se alivia, por ejemplo, la verificación de buenas prácticas de manufactura para los insumos. Sin embargo, cuando no se cuenta con esta autorización previa, corresponde a la autoridad regulatoria nacional comprobar la calidad, seguridad y eficacia de algún producto.
Esto significa que de cualquier forma existe una evaluación previa para el ingreso de insumos al país.
Bustamante señaló que países de alta vigilancia sanitaria no autorizaron el ingreso de Sinopharm a su territorio, lo cual es falso.
El Decreto Supremo Nº 001-2019-SA reconoce a los países con alta vigilancia sanitaria. Entre ellos se encuentra Hungría, que se convirtió en uno de los primeros países de la Unión Europea en autorizar la vacuna china de Sinopharm. En febrero pasado, el primer ministro Viktor Orbán de este país se inoculó con la vacuna china como un recurso para generar confianza en la población.
Cada país define cuáles son las autoridades sanitarias de alta vigilancia. Por ejemplo, en Chile se define como agencias reguladoras de medicamentos de alta vigilancia a las que se encuentran en la lista de Agencias Reguladoras Estrictas de la OMS (SRAs) y a aquellas calificadas en Nivel IV en el Sistema de Evaluación de Autoridades Reguladoras Nacionales de Medicamentos de la Organización Panamericana de la Salud (OPS).
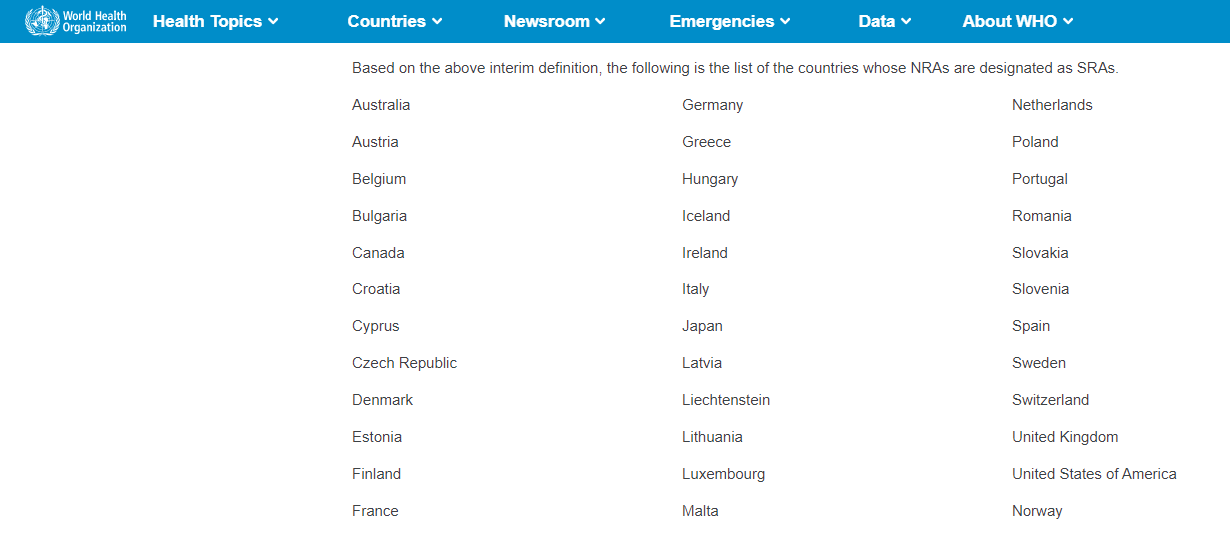
Lista de Agencias Reguladoras Estrictas de la OMS (SRAs).
En el registro de la OPS son reconocidas como agencias de referencia regional las autoridades reguladoras de Argentina (ANMAT), Brasil (ANVISA), Canadá (HS), Chile (ISP), Colombia (INVIMA), Cuba (CECMED), México (COFEPRIS) y Estados Unidos de América (FDA).

Lista de autoridades reguladoras de referencia de la OPS.
Argentina autorizó el uso de la vacuna de Sinopharm en febrero pasado y realizó un estudio sobre su efectividad. En tanto, la autoridad reguladora de Brasil recibió la solicitud de evaluación del laboratorio chino.
Además de estas autorizaciones, en mayo pasado, la vacuna de Sinopharm fue recomendada por la Organización Mundial de la Salud (OMS) para su uso de emergencia. "La OMS que es un órgano técnico referente que maneja parámetros estrictos también dio la autorización para el uso de la vacuna", indica Carmen Ponce.
El epidemiólogo Antonio Quispe, integrante del equipo de transferencia de gestión del sector salud, también confirmó a Convoca Verifica que la OMS ha reconocido la efectividad y seguridad de la vacuna de Sinopharm.


 Sé el primero en leer nuestras publicaciones
Sé el primero en leer nuestras publicaciones