Convoca a tu servicio: Guía sobre las vacunas contra el COVID-19 y las pruebas con voluntarios
Por Elena Miranda | 29 Septiembre, 2020
En el Perú, dos laboratorios extranjeros están realizando ensayos clínicos de las vacunas contra el COVID-19. La corporación china Sinopharm y la biofarmacéutica alemana Curevac están aplicando sus candidatas a vacunas en voluntarios de nuestro país y, próximamente, se sumarán otras compañías que están tramitando los permisos de las autoridades de salud. Para aclarar las dudas y consultas sobre los derechos y obligaciones de las personas que participan en los ensayos clínicos, Convoca a tu Servicio entrevistó al médico Franco Romaní, director general de la Oficina de Investigación y Transferencia Tecnológica (OGITT) del Instituto Nacional de Salud (INS), y al médico Aldo Vivar, presidente del Comité Nacional Transitorio de Ética e Investigación para COVID-19 y elaboramos esta guía sobre todo lo que debes saber.
Derechos y obligaciones de los voluntarios
¿Qué derechos tiene el voluntario que participa en los ensayos clínicos de las vacunas contra el COVID-19?
Aldo Vivar: Tiene los siguientes derechos:
-A ser respetado como persona y como participante de un protocolo de investigación.
-A estar informado, a que se le respondan todas sus dudas y preguntas, no solo el primer día sino durante todo el proceso. El seguimiento es mínimo un año.
-A que los procedimientos se cumplan, como se le ofreció en el formato inicial.
-A ser informado de cualquier cambio que ocurra y pedirle, nuevamente, su consentimiento, si acepta el cambio.
-A retirarse en cualquier momento, sin dar ninguna explicación. Tiene que decir “ya no deseo participar en el estudio”. Eso no invalida su derecho como usuario de un establecimiento de salud, para consultar por cualquier problema médico que tuviera.
¿Qué obligaciones tienen los voluntarios que se comprometen a participar en un ensayo clínico?
Aldo Vivar: Deben cumplir lo que se les pide que hagan y eso está en el formato de consentimiento. Si se compromete a recibir la vacuna, se compromete a acudir a los controles, a no perderse de vista. El compromiso es mínimo un año. Tiene que sacarse muestras de sangre, pesarse, tallarse, recibir llamadas telefónicas diarias, acudir al centro de investigación cuando se le solicite y ser responsable con el uso de los anticonceptivos.
¿Qué puede hacer un voluntario si percibe que han sido vulnerados sus derechos?
Aldo Vivar: En el formato de consentimiento, está el nombre del investigador principal y su teléfono o su correo electrónico, para poder comunicarse. El segundo contacto es con el Comité de Ética. Sale el nombre del presidente, un teléfono y un email, donde puede hacer su reclamo y está la dirección electrónica de la OGITT.
¿Cuál es el proceso para investigar la denuncia de un voluntario?
Aldo Vivar: Recogemos la queja y la trasladamos al investigador. Si no recibimos una explicación satisfactoria, tenemos la potestad de acudir al centro de investigación y revisar los documentos concernientes a este participante. Dependiendo de lo que haya ocurrido, si hubiera una negligencia, establecemos una sanción. Esa sanción puede llevar a la suspensión de la investigación, cuando se demuestra que no se ha llevado de manera científica y ética.
Franco Romaní: Hay muchos mecanismos por los cuales podemos captar alguna desviación del protocolo, alguna denuncia, algún evento adverso. El INS supervisa a los centros de investigación donde se están enrolando pacientes de un estudio clínico. Estas inspecciones generan toda la evidencia que, dependiendo de la gravedad de la desviación, pueden llevar a sugerir al patrocinador o responsable del ensayo a cancelar un centro de investigación de un ensayo clínico.

Las vacunas chinas contra el COVID-19 ya se están aplicando a dos grupos de voluntarios en el Perú. Foto: Difusión
Efectos adversos de la vacuna
¿Cómo diferenciar un efecto adverso de la vacuna de uno que no lo es?
Aldo Vivar: El primer canal es la información que se tiene de los estudios previos. Los estudios que están llegando al Perú son de fase 3. Estos ensayos ya han dado información sobre algunos efectos adversos en las fases 1 y 2. El siguiente canal son los eventos inesperados. El equipo de investigación toma la decisión en base a la historia clínica de la persona y al examen clínico.
¿Qué reacciones adversas pueden tener los voluntarios con las vacunas?
Aldo Vivar: Las reacciones adversas a la vacuna son de dos tipos: las reactivas, que son las reacciones en el sitio de inyección, como dolor, moretón, alguna reacción inflamatoria u otro tipo de reacción que se tiene reportada de estudios previos. Las otras son las reacciones sistémicas, que no son inmediatas, como alergias, que son inesperadas, que no han sido reportadas anteriormente. Mientras más personas prueben la vacuna, más reacciones se van a detectar.
¿Qué pasa cuando se presentan efectos adversos?
Aldo Vivar: El deber del participante es informar que tiene un efecto adverso. Tiene derecho a que el médico y los investigadores del estudio averiguen qué está pasando y hagan algo para mitigar, atenuar o para eliminar la molestia o el evento adverso y luego, acompañarlo en esto. La mitigación del evento no corre por cuenta del participante sino del ensayo de la investigación.
Franco Romaní: Los patrocinadores o las instituciones encargadas de hacer estas investigaciones son las responsables de notificar al INS un evento adverso. Además, de activar la póliza para resarcir ese problema, tienen la responsabilidad de informarnos. Luego del análisis, informamos a la Digemid, para que le haga un seguimiento más estricto a esta vacuna o fármaco.
¿Qué ocurre si la voluntaria o la pareja del voluntario se embaraza?
Aldo Vivar: La primera salvaguarda es informar que no debe ocurrir embarazos en la persona ni en la pareja de la persona que recibió la vacuna. Los investigadores deben proveer de los métodos anticonceptivos seguros, sobre todo de los hormonales, y el participante se debe comprometer a usarlos. El embarazo es considerado un efecto adverso. Es importante que la mujer que sale embarazada notifique oportunamente a los investigadores para activar los mecanismos. La regulación peruana exige que se siga el embarazo hasta el momento del parto y hasta seis meses después del nacimiento.
¿Qué cubre la póliza de seguro que se otorga al voluntario?
Franco Romaní: La póliza debe cubrir cualquier circunstancia o evento derivado del uso de los productos de investigación dentro del ensayo clínico, de la vacuna o del placebo. Si generan algún evento adverso o reacción, son cubiertos por la póliza por el monto previsto en el contrato, que es medio millón de dólares.

Personal del Instituto Nacional de Salud debe supervisar los ensayos clínicos con voluntarios en el Perú. Foto: Difusión
No debe ocurrir embarazos en la persona ni en la pareja de la persona que recibió la vacuna", Sandro Vivar, presidente del Comité de Ética e Investigación para COVID-19
Expertos autorizan y supervisan ensayos con voluntarios en Perú
¿Quién autoriza los ensayos clínicos de la vacuna contra el COVID-19 en el Perú?
Franco Romaní: El Reglamento Nacional de Ensayos Clínicos establece que un patrocinador de la vacuna o medicamento que se quiere estudiar en un ensayo en personas debe solicitar una autorización al Instituto Nacional de Salud (INS). Debe tener, previamente, la aprobación de un Comité de Ética acreditado por el INS. Además, se requiere la opinión de la Dirección General de Medicamentos, Insumos y Drogas (Digemid), sobre la calidad y seguridad de la vacuna o del fármaco que se pretende estudiar. Con las opiniones de esas dos instancias, el INS revisa el expediente y autoriza el ensayo clínico.
¿El que se hayan reducido los plazos para las autorizaciones durante la pandemia ha significado bajar el nivel de exigencia?
Franco Romaní: Antes de la emergencia sanitaria, cuando el patrocinador venía con la aprobación del Comité de Ética, el plazo para dar las autorizaciones era de 30 días. En la emergencia, dura siete días, desde que el expediente ingresa. Además, se han establecido otros mecanismos de revisión simultánea. Hemos acelerado los procesos sin sacrificar la revisión de la calidad del expediente. Esto es para todo producto de investigación, vacuna, producto químico o producto biológico, vinculado al COVID-19.
¿Quiénes conforman el Comité de Ética que aprueba los ensayos y qué garantiza su independencia?
Aldo Vivar: Somos unos 20 profesionales que fuimos convocados por el INS, al inicio de la emergencia sanitaria. Hay médicos, enfermeras, químicos farmacéuticos, biólogos, psicólogos, abogados y miembros de la comunidad. Nuestro trabajo es ad honorem y revisamos la parte ética de los protocolos de investigación de todos los proyectos que tienen que ver con el COVID-19.
¿Qué hace que un estudio con voluntarios sea ético?
Aldo Vivar: Hay que tener en cuenta varios puntos.
-Que tenga un valor social, que lo que se está estudiando interese a las personas. Es indudable el valor social de hacer estudios sobre el COVID-19.
-Que el estudio, científicamente, esté correctamente diseñado.
-Que todos los sujetos tengan el mismo derecho a participar, que no se discrimine a personas por ninguna condición, de raza, de género, por regiones.
-Que no sea un gran riesgo aplicar estos productos en seres humanos y que los beneficios sean razonables, es decir, minimizar los riesgos.
-Que se le informe al voluntario el propósito del estudio, los procedimientos que le van hacer: el examen físico, que se le va a sacar sangre, qué reacciones le puede provocar.
-Que toda la información sea entregada en un lenguaje claro al voluntario y si se siente confiado de participar, acepte y firme un formato que se llama consentimiento informado.

Voluntaria en la prueba de la vacuna contra el COVID-19 firma un consentimiento informado en sede de la Universidad Nacional Mayor de San Marcos. Foto: Difusión/Presidencia de la República
Inspecciones a los ensayos con voluntarios
¿Cada cuánto tiempo el INS realiza las inspecciones?
Franco Romaní: No se inspeccionan de manera ordinaria todos los ensayos clínicos, pero sí le damos énfasis a la inspección de estudios que incluyen a población vulnerable, gestantes, adultos mayores, niños y los que tienen un potencial impacto en la salud pública. Las inspecciones se hacen a partir del enrolamiento. Los inspectores van al centro de investigación, revisan la documentación del ensayo clínico, que los consentimientos informados estén adecuadamente completos, legibles, la coherencia de la información de los consentimientos informados, la documentación respecto a los datos de seguridad del estudio, cualquier tipo de queja o consulta que tengan documentada los miembros o participantes, toman muestras del producto de investigación. También existen las inspecciones extraordinarias, con la intención de corregir desviaciones flagrantes y recopilar la documentación de la investigación del caso.
¿Qué otro tipo de reportes deben presentar los patrocinadores al INS?
Franco Romaní: Deben presentar informes de los avances: el número de personas que van enrolando, si hay algún tipo de evento adverso, si hay alguna dificultad. La información de los reportes se verifica con las inspecciones a algunos centros de investigación durante la ejecución del ensayo.
Aldo Vivar: El Comité de Ética recibe informes mensuales y trimestrales. Recibe el informe de enrolados, de efectos adversos, detalles de las inspecciones que realiza la OGITT. Tenemos la potestad de hacer inspecciones en los centros de investigación y comunicarnos con los voluntarios. Es posible que algunos participantes reciban una llamada del Comité de Ética, para saber qué está pasando con ellos, cómo se sienten, si han recibido toda la información que necesitan, si tienen alguna duda respecto a lo que están haciendo con ellos.
¿El Comité de Ética puede iniciar una investigación de oficio?
Aldo Vivar: Sí. Si estamos recibiendo información de los centros de investigación de que hay muchos efectos adversos, muchas desviaciones al protocolo, podemos preguntar al investigador qué está pasando y si no nos satisface esa respuesta, tenemos el derecho de acudir al centro, revisar los archivos y conversar con los participantes. No vamos a esperar a que haya grandes problemas para actuar.
Vigilancia ciudadana de los ensayos clínicos
¿Cuáles son los límites de la confidencialidad en los ensayos clínicos y qué información se puede conocer para ejercer una vigilancia ciudadana?
Franco Romaní: La confidencialidad es sobre los datos personales que recogen los ensayos clínicos, datos de interés o de protección del producto de investigación. Todo aquello que se divulga está en el Registro de Ensayos Clínicos en el Perú (Repec), donde cualquier persona puede ver qué ensayos clínicos se están haciendo, qué centros de investigación están enrolando, cuántas personas se piensan enrolar, quién es el investigador principal.
¿El voluntario también debe guardar la confidencialidad o puede divulgar la información sobre el estudio?
Franco Romaní: El voluntario suscribe un consentimiento informado, respecto a que es consciente de que está participando en un ensayo, que conoce todos sus riesgos y beneficios. No suscribe un acuerdo de confidencialidad.
¿Si se hace una investigación y se establece una sanción, esta es de conocimiento público?
Aldo Vivar: Si el Comité de Ética encuentra algún evento serio, comunicamos inmediatamente al INS, que es la entidad regulatoria autorizada para tomar acciones
Franco Romaní: Hay varios canales por los cuales tomamos cuenta de los eventos adversos: Hallazgos del Comité de Ética, el reporte del patrocinador, a través del registro de acciones adversas o una inspección que haga el INS. Se analiza y se comunica a la Digemid.
¿Se puede llegar al Poder Judicial cuando hay alguna negligencia o incumplimiento de las normas?
Franco Romaní: Sí. El tema judicial lo debería manejar la instancia del Gobierno que defiende los intereses de su población. Nosotros no entramos en ese aspecto. Vemos, la parte regulatoria y que estos ensayos clínicos se conduzcan siguiendo las buenas prácticas de investigación, las buenas prácticas clínicas.
¿Cómo se accede a los resultados de la eficacia de la vacuna?
Franco Romaní: Debemos publicar en el Repec el informe final de los resultados preliminares que nos remita el patrocinador. El patrocinador debe publicar el ensayo clínico en una revista nacional e internacional y remitir una copia de ese artículo al INS.
Aldo Vivar: No solo es un deber sino una necesidad del patrocinador publicar sus resultados, porque eso lo tiene que informar a la comunidad científica. La obligación internacional es tanto si el estudio resultados positivos como negativos.
¿Qué hace tan atractivo al Perú para que los laboratorios extranjeros quieran realizar los ensayos clínicos de sus vacunas?
Aldo Vivar: Lo hace atractivo algo que, realmente, es malo para nosotros: tener tantos casos de COVID-19. Lamentablemente, ese es el atractivo. Un grupo va a recibir el producto que se está investigando y el otro grupo va a recibir una sustancia inocua. Los científicos van a ver la diferencia entre cuántos hacen COVID-19 en cada grupo. Si se hace un ensayo clínico, por ejemplo, en Nueva Zelanda, donde la tasa de COVID es muy baja, para ver la diferencia científica, tiene que pasar muchísimo tiempo, de repente dos o tres años. Como en el Perú hay muchos casos de COVID, la diferencia va a verse más rápido.
Foto principal: Difusión/Presidencia de la República
Más en Convoca a tu servicio
Infogram

 Menú
Menú
 Buscar
Buscar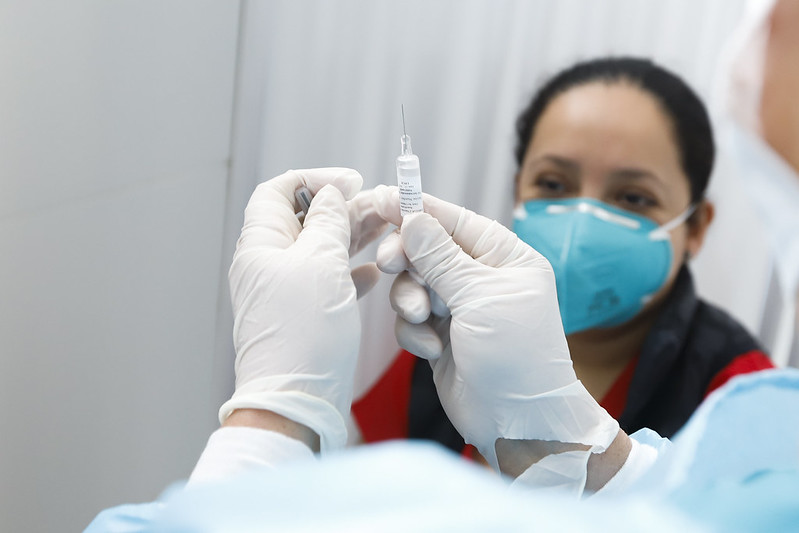


 Sé el primero en leer nuestras publicaciones
Sé el primero en leer nuestras publicaciones